Fique por dentro de tudo!
Participe do nosso canal direto no WhatsApp para receber em primeira mão as novidades, lançamentos e oportunidades exclusivas da Kasvi.
8 min de leitura
O termo “blotting” refere-se à transferência de amostras biológicas de um gel para uma membrana e sua subsequente detecção. Um experimento western blot ou western blotting ou protein immunoblotting foi introduzido por Towbin, em 1979 e tornou-se uma técnica de rotina muito utilizada na biologia molecular para análise de proteínas. Com esta técnica é, também, possível obter informações sobre a massa molecular e a quantidade relativa existente dessa proteína específica numa determinada amostra.
A técnica western blotting baseia-se na separação das proteínas por peso molecular através de uma eletroforese, seguindo-se da transferência para uma membrana e a detecção da proteína de interesse com um anticorpo específico.
Os passos para a elaboração dessa técnica podem ser resumidos em cinco etapas:
A primeira etapa é a realização da extração e a quantificação das proteínas. Dos métodos espectroscópicos utilizados nessa etapa para quantificação, o ensaio de Bradford destaca-se, pois é mais rápido, não exige aquecimento e apresenta alta sensibilidade para baixas concentrações de proteínas.
O método de Bradford se baseia na mudança de cor através das interações hidrofóbicas e iônico que estabilizam o complexo proteína-corante (da solução ácida avermelhada para a cor azulada com presença de proteínas). Para quantificar a concentração de proteínas na amostra deve-se fazer uma curva de padronização com concentrações conhecidas de uma proteína (soroalbumina bovina, BSA) versus absorbância em 595 nm (comprimento de onda que o complexo proteína-corante absorve). A partir dessa curva obtém-se a equação de ajuste linear na qual é possível substituir os valores médios de absorbâncias das amostras, resultando nos valores da concentração das proteínas. Para uma maior confiabilidade dos resultados, o coeficiente de correlação linear deve ser maior que 0,98.
Para separar as proteínas de uma amostra homogênea, a técnica mais utilizada é a eletroforese em gel de SDS-poliacrilamida (SDS-PAGE). A eletroforese em gel é uma técnica na qual moléculas carregadas, como as proteínas, são separadas de acordo com suas propriedades físicas e peso molecular à medida que passam por uma corrente elétrica. A técnica de SDS-PAGE é largamente utilizada, pois é capaz de separar todos os tipos de proteínas, mesmo aquelas que são normalmente insolúveis em água (como por exemplo muitas proteínas de membranas). Além disso, como as proteínas são separadas por tamanho, é possível estimar o peso molecular e a composição das subunidades da proteína. Essas proteínas podem ser visualizadas diretamente no SDS-PAGE por coloração direta do gel, por corantes como o Comassie-Blue ou por tratamentos com nitrato de prata. O nitrato de prata é um dos métodos mais sensíveis de detecção, que permite a visualização de proteínas de até 10ng, enquanto que a coloração por Coomassie-Blue detecta proteínas de até 300ng.
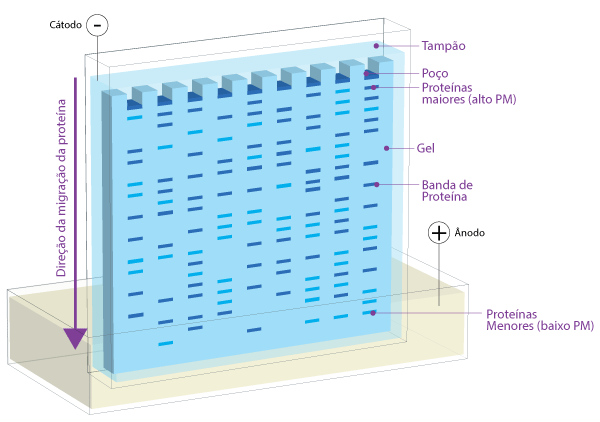
Após a eletroforese, a proteína deve ser transferida do gel para uma membrana. Há uma variedade de métodos usados neste processo que incluem, transferência por difusão, transferência por capilaridade, transferência a vácuo. Porém, a mais comumente usada é a eletroeluição ou electroblotting, devido à sua velocidade e eficiência de transferência. O processo envolve o uso de almofadas porosas e papel de filtro para facilitar a transferência. Quando um campo elétrico é aplicado, as proteínas se movem para fora do gel de poliacrilamida e para a superfície da membrana, onde as proteínas se ligam firmemente. O resultado é uma membrana com um padrão de proteína igual ao que estava originalmente no gel de poliacrilamida.
A eficiência da transferência depende de fatores como a composição do gel, o contato completo do gel com a membrana, a posição dos eletrodos, o tempo de transferência, o tamanho e a composição das proteínas, a intensidade de campo e se há a presença de detergentes e álcool no tampão.
Depois de terminado o tempo de aplicação da corrente elétrica, usa-se um corante denominado Ponceau S para confirmar a transferência das proteínas para a membrana, e verificar se essa transferência ocorreu de maneira igual para todas as amostras. Em caso afirmativo, pode ser dada continuidade ao experimento de western blotting.
A membrana possui uma alta afinidade por proteínas, dessa forma, é necessário bloqueá-la para evitar que os anticorpos se liguem a toda a superfície da membrana e não, como desejado, especificamente ao antígeno. Para bloquear a membrana geralmente é utilizado leite em pó desnatado (LD), mas polímeros sintéticos como a poli-vinil-pilorridona (PVP) também podem ser usados, especialmente em casos onde os componentes do leite prejudicam a ligação antígeno/anticorpo.
O bloqueio é realizado com a solução de bloqueio (tampão TBS pH 7,5 + Tween 20 0,3% + Leite Desnatado 5%) por 1 hora incubado em temperatura ambiente em constante agitação. Após o bloqueio, a membrana é lavada com a solução de lavagem (TBS + Tween 20 0,3%) por 3x a cada 5 minutos.
Depois de lavada, é adicionada a membrana o primeiro anticorpo (ou amostra de soro), ou seja, aquele que se ligará ao antígeno presente na membrana. A diluição do anticorpo é realizada na solução de bloqueio (tampão TBS pH 7,5 + Tween 20 0,3% + Leite Desnatado 5%). A diluição de 1/100 é a padronizada em alguns protocolos para a utilização do soro de pacientes. Após a aplicação na membrana, a mesma deve ser incubada em temperatura ambiente por 1 hora em constante agitação.
O segundo anticorpo (conjugado) pode ser definido como moléculas de antígenos ou anticorpos ligados covalentemente à enzima, de modo a conservar as duas funções das duas moléculas conjugadas: atividade enzimática da enzima e antigenicidade do antígeno ou especificidade da imunoglobulina. Esse anticorpo é um anti-IgG, ou seja, é um anticorpo que reconhece um anticorpo. Por exemplo, se foi utilizado um anticorpo primário anti uma proteína de interesse, produzido em camundongo, será utilizado um anticorpo secundário anti-IgG de camundongo, que reconhecerá qualquer anticorpo produzido em camundongo. Esse anticorpo secundário possui alguma modificação que permitirá a visualização da proteína de interesse:
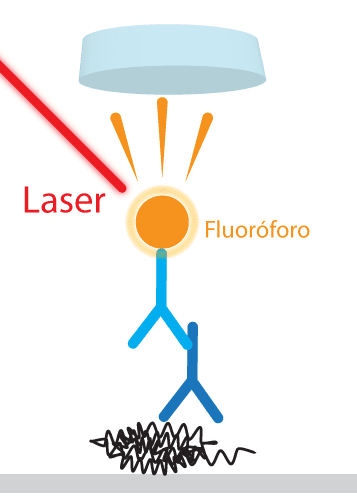
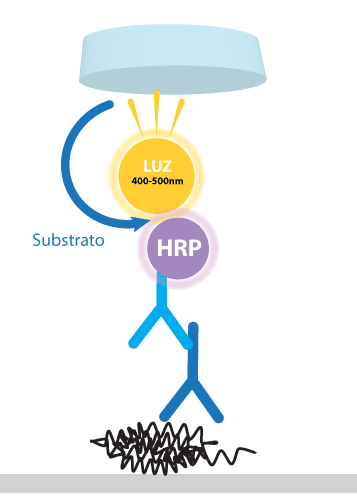
Algumas enfermidades infecciosas de animais podem ser diagnosticadas por western blotting. Um exemplo é o diagnóstico de encefalopatias espongiformes transmissíveis (EETs), desordens neurodegenerativas crônicas fatais provocadas por príons, que podem acometer animais e seres humanos. Outra doença importante na medicina veterinária é a leishmaniose visceral americana (LVA), causada pela Leishmania chagasi. Esta enfermidade é de grande importância em saúde pública por ser uma zoonose, e ter o cão reconhecido como um importante hospedeiro.
